بهترین و جدیدترین روش های درمان واریس
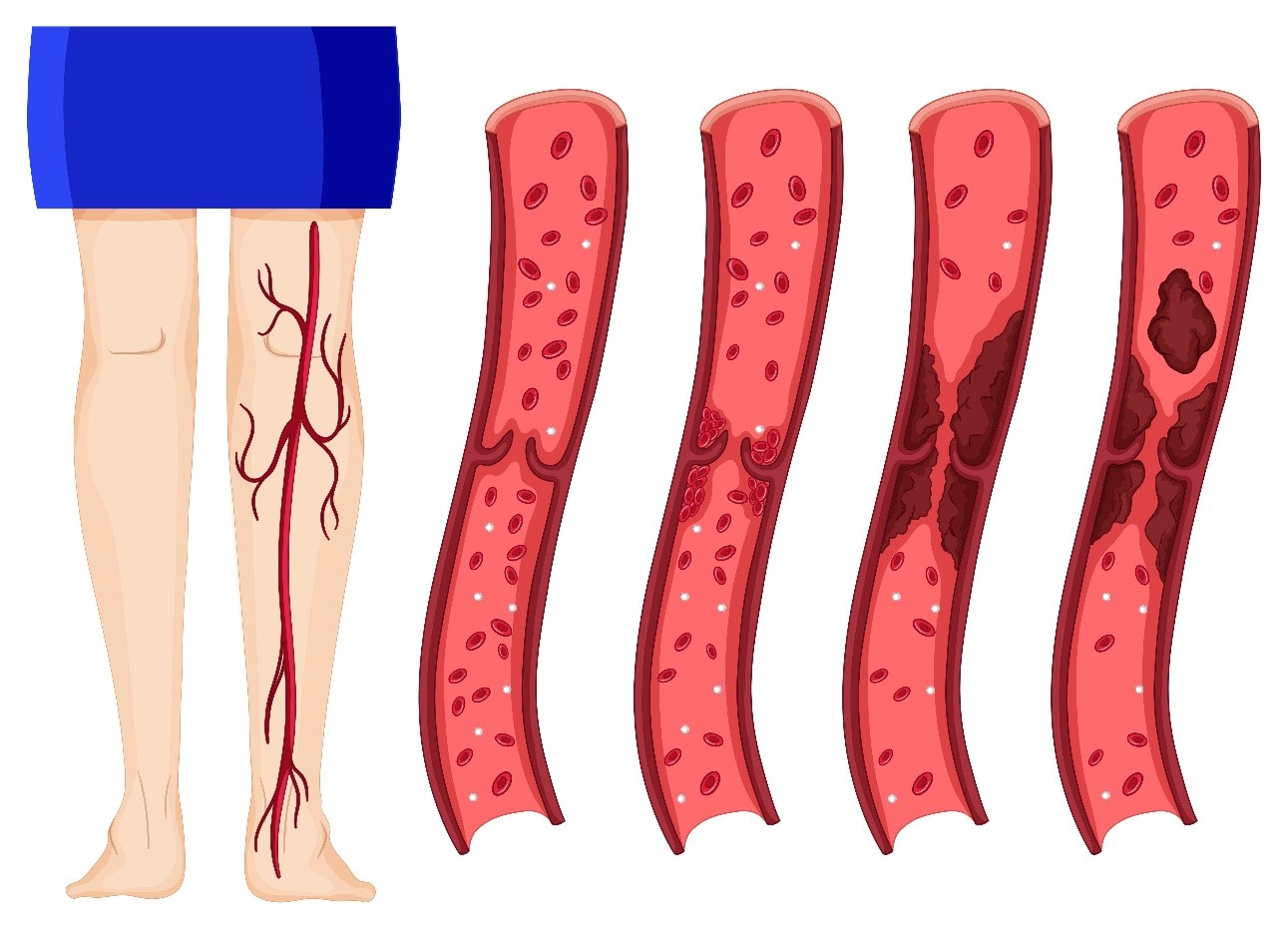
درمان واریس: ابلیشن و اسکلروتراپی - مروری جامع بر آخرین رویکردهای بالینی
نارسایی مزمن وریدی (CVI) یک اختلال شایع و پیشرونده است که به طور مستقیم بر کیفیت زندگی بیماران تأثیر میگذارد. مدیریت مؤثر واریسهای سطحی نیازمند درک عمیق از پاتوفیزیولوژی، تکنیکهای تشخیصی استاندارد (به ویژه اولتراسوند داپلر پیشرویکردی) و تسلط بر روشهای نوین کمتهاجمی نظیر ابلیشنهای حرارتی درونوریدی (EVLA و RFA) و اسکلروتراپی هدایتشده با سونوگرافی (UGFS) است. این مقاله مروری جامع و تخصصی با تمرکز بر اصول بیوفیزیکی، پروتکلهای بالینی و مدیریت عوارض، برای پزشکان متخصص و جراحان عروق ارائه میدهد تا استانداردهای درمانی را به بالاترین سطح ارتقا دهند.
پاتوفیزیولوژی نارسایی مزمن وریدی و واریسها
واریس ها (Varicose Veins) ناشی از اتساع و کژدیسی پایدار سیستم وریدی سطحی هستند که نتیجه مستقیم نارسایی مزمن وریدی (CVI) است. هسته اصلی این پاتوفیزیولوژی، اختلال در عملکرد دریچه های وریدی (Venous Valves) و جریان برگشتی خون (Venous Reflux) است.
- مکانیسم اختلال عملکرد دریچه ای
دریچههای وریدی برای اطمینان از جریان خون یکطرفه به سمت قلب طراحی شدهاند. با گذشت زمان یا در اثر عوامل ژنتیکی/محیطی، دیواره ورید دچار اتساع و نازک شدن (Wall Dilatation) میشود. این اتساع باعث افزایش فاصله بین لبههای دریچه (Coaptation Failure) شده و منجر به برگشت خون در طول چرخه وریدی میشود.
جریان برگشتی (Reflux) باعث افزایش فشار هیدروستاتیک درون ورید میشود. این فشار به ویژه در اندام تحتانی و در وضعیت ایستاده به اوج خود میرسد. - پیامدهای همودینامیک و آسیب بافتی
افزایش مزمن فشار وریدی (Venous Hypertension) منجر به مکانیسمهای آسیب بافتی میشود:
- افزایش نفوذپذیری مویرگی: فشار بالا باعث خروج پروتئینها، فیبرینوژن و گلبولهای قرمز به فضای اینترستیتال میشود.
- فیبروز پریونولار: رسوب فیبرین در اطراف وریولها منجر به محدودیت تبادل اکسیژن و مواد مغذی میشود.
- پاسخ التهابی: فعالیت لکوسیتها و آزادسازی سیتوکینها باعث ایجاد پاسخ التهابی مزمن میشود که در نهایت به درماتیت اکتسابی وریدی و زخم وریدی منجر میگردد. - ارتباط با سیستم طبقهبندی CEAP
سیستم CEAP (Clinical-Etiological-Anatomical-Pathophysiological) ابزار استاندارد جهانی برای توصیف و دستهبندی CVI است. برای تمرکز بر درمانهای ابلیشن و اسکلروتراپی، توجه به دو جزء اصلی حیاتی است:
- A (Anatomic): محل آناتومیک ورید درگیر (مانند GSV، SSV، یا پرفورانتورها).
- P (Pathophysiological): علت زمینهای (مانند ریفلاکس وریدی یا انسداد).
تشخیص کلاس های C1 تا C6 در تعیین استراتژی درمانی (از مشاوره تا مداخلات تهاجمی) نقش اساسی دارد. درمانهای ابلیشن و اسکلروتراپی عمدتاً بر ریشهکنی علل اصلی ریفلاکس (معمولاً واریسهای تنه اصلی نظیر GSV یا SSV) متمرکز هستند.
استانداردهای تشخیصی: نقش حیاتی سونوگرافی داپلر پیش رویکردی
قبل از هرگونه مداخله، نقشهبرداری دقیق وریدی (Venous Mapping) با استفاده از سونوگرافی داپلر رنگی استاندارد طلایی است. این مرحله نه تنها تأیید کننده وجود ریفلاکس است، بلکه امکان برنامهریزی دقیق درمان هدفمند را فراهم میآورد.
** سیستم طبقهبندی CEAP در پرتو سونوگرافی
سونوگرافی داپلر امکان تأیید و مستندسازی اجزای آناتومیک (A) و پاتوفیزیولوژیک (P) را فراهم میآورد:
کلاس CEAPیافته سونوگرافیک مرتبطC2وریدهای سطحی اتساعیافته ((> 3 , \text{mm}) در حالت ایستاده برای وریدهای غیرسفالو-پایینتر)C3ادم مرتبط با فشار وریدی بالاC4-C6شواهدی از آسیب بافتی ناشی از نارسایی مزمن
** معیارهای استاندارد برای تعریف ریفلاکس (Reflux Criteria)
تشخیص قطعی ریفلاکس نیازمند ارزیابی زمان برگشت جریان خون پس از انجام مانورهای تحریکی (مانند مانور والسالوا برای سیستم وریدی فوقانی یا فشردهسازی سریع دیستال برای سیستم وریدی تحتانی) است.
- زمان ریفلاکس (Reflux Time): جریان برگشتی که مدت زمان آن از آستانه تعیین شده تجاوز کند، به عنوان ریفلاکس مرضی در نظر گرفته میشود.
- وریدهای تنه اصلی (GSV/SSV): ریفلاکس باید (> 0.5) ثانیه (برخی مراکز (> 1.0) ثانیه) باشد.
- وریدهای شاخهای (Tributaries): ریفلاکس باید (> 1.0) ثانیه باشد. - قطر ورید (Diameter): اتساع ورید نشاندهنده فشار بالای مزمن است و پیشبینی کننده موفقیت بهتر در ابلیشن حرارتی است.
- EVLA/RFA کاندیدا: وریدهای بسیار کوچک (< 2 ,) معمولاً به اسکلروتراپی ترجیح داده میشوند. - محل شروع ریفلاکس: تعیین دقیق نقطه شروع و طول بخش درگیر، برای تعیین طول مورد نیاز برای درمان حرارتی (تخریب دیواره ورید تا نزدیکی فمورال/پاپلیته) حیاتی است.
** تکنیکهای ابلیشن حرارتی درونوریدی (Endovenous Thermal Ablation)
ابلیشن حرارتی، هدف اصلی درمان CVI درجه متوسط تا شدید، شامل تخریب حرارتی دیواره ورید به منظور فیبروز و انسداد دائمی آن است.
لیزر درونوریدی (EVLA – Endovenous Laser Ablation)
EVLA از انرژی لیزر برای القای آسیب حرارتی کنترل شده به اندوتلیوم ورید استفاده میکند.
- بیوفیزیک و طول موجهای انتخابی
موفقیت EVLA شدیداً وابسته به جذب انرژی لیزر توسط بافت هدف است:
- طول موجهای سنتی (مثلاً ۸۱۰/۹۸۰ نانومتر): این طول موجها عمدتاً توسط آب جذب میشوند.
- طول موجهای نسل جدید (۱۴۷۰ نانومتر): طول موج (1470 nm) به دلیل جذب بسیار بالا توسط مولکولهای آب و جذب متوسط توسط هموگلوبین، انرژی را به صورت مؤثرتری در طول دیواره ورید توزیع میکند. این امر باعث کاهش نیاز به انرژی (Fluence) و کاهش آسیب به بافتهای اطراف (به ویژه پوست و اعصاب) میشود. - موقعیت فیبر و محاسبه انرژی
دستیابی به انسداد کامل نیازمند توزیع مناسب انرژی است. فیبر لیزر باید در مرکز لومن ورید قرار گیرد.
- محاسبات انرژی: میزان انرژی تحویلی (Energy Density) معمولاً بر اساس طول موج و قطر ورید تنظیم میشود.
واحد استاندارد «انرژی خطی» (Linear Energy Density - LED) بر حسب (cm \ Joules ) است.
برای وریدهای قطورتر ((> 10 , \text{mm})) یا استفاده از طول موجهای کمتر جذبشونده، LED بالاتری ((100-120 , \text{J}/\text{cm})) استفاده میشود، در حالی که برای وریدهای نازکتر یا با لیزر ۱۴۷۰ نانومتر، LED پایینتر (60-80) کفایت میکند. - نقش حیاتی بیحسی تومسانتی (Tumescent Anesthesia)
تکنیک تومسانت یک عنصر ضروری در EVLA است و دو عملکرد اصلی دارد:
- محافظت حرارتی: محلول تومسانت (اغلب لیدوکائین + اپینفرین رقیق شده و نرمال سالین) به عنوان یک عایق حرارتی عمل کرده و انرژی لیزر را جذب میکند تا از آسیبهای حرارتی به پوست و عصب سافنوس مجاور جلوگیری شود.
- کمپرس موضعی: حجم زیاد مایع تزریق شده، لومن ورید را فشرده میکند و باعث تماس بهتر فیبر با دیواره ورید و افزایش کارایی جذب حرارت توسط دیواره میشود.
ترکیب معمول: (50 , \text{mL}) لیدوکائین (1%) به علاوه (1 , \text{mL}) اپینفرین (1:1000) در (500 , \text{mL}) سالین نرمال.
ابلیشن با فرکانس رادیویی (RFA – Radiofrequency Ablation)
RFA نیز یک روش حرارتی است که از انرژی الکترومغناطیسی برای ایجاد آسیب حرارتی استفاده میکند.
- مکانیسم حرارتی و کنترل دما
برخلاف لیزر که از تابش متمرکز استفاده میکند، RFA با استفاده از یک کاتتر الکترود، انرژی را به صورت تماس مستقیم به دیواره ورید منتقل میکند. کاتترهای مدرن (مانند سیستم ClosureFast) از مکانیزمهای حرارتی تقسیمبندی شده (Segmental Heating) استفاده میکنند.
- Heating Pattern: این کاتترها دارای چندین الکترود در طول نوک خود هستند که اجازه میدهند کنترل دقیقی بر دمای سطح مقطع ورید اعمال شود.
- کنترل دمای حلقه بسته (Closed-Loop Temperature Control): کاتترهای پیشرفته، دمای محیطی را به طور مداوم اندازهگیری کرده و توان خروجی را تنظیم میکنند تا دمای دیواره ورید در محدوده بهینه ((85^\circ\text{C}) تا (120^\circ\text{C})) باقی بماند، که این امر منجر به تخریب فیبروتیک پایدار میشود. - مراحل پروسیجر RFA
- ورود و جایگذاری: کاتتر از طریق یک سوراخ کوچک (Puncture) در نزدیکی محل ریفلاکس وارد شده و تحت هدایت سونوگرافی در فاصله (2-3 , \text{cm}) از دهانه سفنوفمورال (SFJ) یا سفنوپاپلیته (SPJ) موقعیتدهی میشود.
- تزریق تومسانت: مشابه EVLA، تزریق مایع تومسانت برای محافظت از بافتهای اطراف و فشردهسازی ورید ضروری است.
- حرکت و ابلیشن: کاتتر با سرعت ثابت و کنترل شده (معمولاً (3-5 , \text{cm}/\text{min})) عقب کشیده میشود، در حالی که انرژی با توجه به قطر ورید اعمال میگردد.
اسکلروتراپی: رویکردی برای وریدهای کوچکتر و شاخهای
اسکلروتراپی فرآیندی است که در آن یک عامل شیمیایی (اسکلروزان) به داخل ورید تزریق میشود تا باعث نکروز اندوتلیوم، التهاب و در نهایت فیبروز و انسداد ورید هدف شود. این روش برای واریسهای بزرگ تنه (جایی که ابلیشن ارجح است) و وریدهای کوچکتر (C1-C3) کاربرد دارد.
طبقه بندی اسکلروزان ها
اسکلروزانها بر اساس مکانیسم عملکرد اصلی دستهبندی میشوند:
نوع اسکلروزانمثالمکانیسم اصلیکاربرد اصلیدترجنتی (صابونی)پلیدوکانول (Polidocanol)، سدیم تترادسیل سولفات (STS)دناتوره کردن پروتئینهای غشای سلولی اندوتلیومواریسهای تنه و شاخهای بزرگ (به صورت فوم)اسموتیک (Osmotic)محلولهای غلیظ نمک (کمتر رایج)افزایش فشار اسمزی و دمینهای سلولیتلانژکتزیها (به صورت مایع)
پلیدوکانول به دلیل کارایی بالا و آستانه پایینتر برای واکنشهای سیستمیک، رایجترین عامل در درمان واریس است.
تکنیک های اصلی اسکلروتراپی
- اسکلروتراپی مایع (Liquid Sclerotherapy)
این روش برای تلانژکتزیها (Spider Veins) و وریدهای مشبک (Reticular Veins) با قطر کم ((< 2 , \text{mm})) استفاده میشود. تزریق به صورت مستقیم با زاویه کم (حدود (10-15) درجه) انجام میشود. - اسکلروتراپی فوم هدایتشده با سونوگرافی (UGFS – Ultrasound-Guided Foam Sclerotherapy)
UGFS روشی پیشرفته است که برای درمان ریفلاکس در شاخههای اصلی (مانند وریدهای پرفورانتور، واریسهای کوچکتر GSV/SSV، یا پسماندههای ابلیشن) به کار میرود. فوم دارای مزیت جایگزینی سریعتر خون و تماس طولانیتر با دیواره ورید است.
روش تهیه فوم (تکنیک Tessari):
فوم از مخلوط کردن اسکلروزان مایع با هوا یا گاز دیاکسید کربن (CO2) تهیه میشود. نسبت اختلاط (Ratio) تعیین کننده ویسکوزیته و عملکرد فوم است.
- نسبت (Air:Sclerosant): رایجترین نسبت در درمان وریدهای تنه اصلی، نسبت ۳:۱ یا ۴:۱ (مثلاً (1 , \text{mL}) پلیدوکانول با (3 , \text{mL}) هوا) است که فوم میکرو (Microfoam) تولید میکند و برای درمان وریدهای قطورتر مناسب است.
- تزریق تحت هدایت سونوگرافی: کاتتر یا سوزن در محل مورد نظر (مثلاً مسیر اصلی GSV) قرار داده میشود. تزریق فوم باید به آرامی انجام شود تا از آمبولی وریدی تصادفی در مسیرهای سیستمیک جلوگیری شود.
ملاحظه تشخیصی در UGFS: هنگام تزریق فوم، اپراتور باید شاهد انسداد ورید هدف و سفید شدن آن (به دلیل عدم بازگشت سونوگرافی از خون) باشد. این امر بر موفقیت پروسیجر دلالت دارد.
نتایج بالینی، مقایسه و عوارض
انتخاب روش درمانی به شدت بر اساس قطر ورید و درجه CVI تعیین میشود. نرخ موفقیت درمانهای مدرن بسیار بالا است، اما مدیریت عوارض جانبی ضروری است.
نرخ موفقیت و بقاء انسداد (Closure Rates)
نرخ موفقیت اولیه (بستهشدن ورید در ارزیابی ۶ هفته تا ۳ ماهه) در هر دو روش ابلیشن حرارتی بسیار بالا است:
- EVLA و RFA: نرخ اولیه انسداد اولیه (Primary Closure Rate) برای وریدهای تنه اصلی (GSV) معمولاً بین ۹۵٪ تا ۹۸٪ در طول ۱۲ ماه اول گزارش میشود.
UGFS: نرخ انسداد اولیه برای واریسهای تنه اصلی (به ویژه در وریدهای کوچکتر یا به عنوان درمان ثانویه) ممکن است کمی پایینتر باشد، اما برای شاخههای جانبی و وریدهای پرفورانتور اغلب ۸۰٪ تا ۹۰٪ است.
الگوهای عود و شکست درمان
عود میتواند ناشی از شکست در درمان اولیه یا ایجاد ریفلاکسهای جدید باشد:
- نزدیکی دهانه سفنوفمورال (SFJ Recanalization): شایعترین محل عود در EVLA/RFA، ناشی از عدم ابلیشن کافی در نزدیکی دهانه ورید یا تشکیل مجدد دریچه در محل دهانه است. این امر با اطمینان از حذف کامل (2-3 , \text{cm}) دیستال به SFJ (در ابلیشن حرارتی) قابل پیشگیری است.
- ایجاد شاخه های جدید (Neovascularization): در برخی موارد، پاسخ بافتی به درمان حرارتی منجر به ایجاد رگهای جدید میشود.
مدیریت عوارض بالقوه
موفقیت درمانی نباید به قیمت ایمنی بیمار تمام شود.
- ترومبوز ورید عمقی (DVT)
خطر DVT پس از ابلیشن حرارتی (EVLA/RFA) بسیار کم است (کمتر از (0.5%))، زیرا درمان تنها بر وریدهای سطحی متمرکز است و مایع تومسانت نیز به عنوان محافظ عمل میکند. با این حال، بیمارانی که سابقه قبلی DVT دارند، باید با دوزهای پروفیلاکتیک هپارین با وزن مولکولی پایین (LMWH) تحت پوشش قرار گیرند. - ترومبوفلبیت سطحی (Superficial Thrombophlebitis)
التهاب و تشکیل ترومبوز در وریدهای درمان نشده یا شاخههای سطحی مجاور شایع است. مدیریت آن معمولاً شامل آنتیبیوتیکهای موضعی و داروهای ضد التهاب غیر استروئیدی (NSAIDs) است. در صورت درگیری بیش از (30 , \text{cm}) از مسیر اصلی ورید، آنتیکوآگولانتها ممکن است لازم باشند. - آسیب عصبی (Nerve Injury)
شایعترین عارضه در درمان واریسهای سافنوس، آسیب به عصبهای حسی مجاور (به ویژه عصب ساپتنیوس در نزدیکی GSV و عصب سفیوس در نزدیکی SSV) است. این آسیب معمولاً موقتی (نوروپاتی حسی) است و به دلیل حرارتدهی بیش از حد یا ناکافی بودن مایع تومسانت در نزدیکی مسیر عصب رخ میدهد.
- پیشگیری: استفاده از تکنیک تومسانت فراوان، موقعیتدهی دقیق کاتتر و اجتناب از انرژی بالا در نزدیکی محل خروج عصبها. - هیپرپیگمانتاسیون و ماتینگ (Matting)
- هیپرپیگمانتاسیون پس از التهاب: در درمان واریسهای کوچک و تلانژکتزیها با اسکلروتراپی، دفع نامناسب هموسیدرین میتواند منجر به لکههای قهوهای (Hyperpigmentation) شود که معمولاً طی ۶ تا ۱۲ ماه محو میشوند.
- ماتینگ (Matting): تشکیل شبکهای از رگهای خونی کوچک و مویینهای در نتیجه التهاب بیش از حد ناشی از اسکلروتراپی یا تزریق ناکافی مایع تومسانت در EVLA. این عارضه نیازمند درمانهای تکمیلی با لیزر اندی:یاگ (Nd:YAG) است.
مدیریت پس از پروسیجر: پروتکلهای فشار درمانی
مدیریت پس از درمان، به اندازه خود مداخله برای دستیابی به موفقیت طولانیمدت حیاتی است. اصلیترین جزء مدیریت پس از درمان، استفاده از فشار درمانی (Compression Therapy) است.
مکانیسم اثر فشار درمانی
فشار خارجی اعمال شده به اندام تحتانی اهداف زیر را محقق میسازد:
- کاهش ادم: از خروج مایع به فضای اینترستیتال جلوگیری میکند.
- تثبیت نتایج ابلیشن/اسکلروتراپی: با فشردهسازی دیواره وریدهای درمان شده، انسداد دائم و فیبروز را تسهیل میکند.
- بهبود دینامیک جریان خون: با کاهش قطر ورید، سرعت جریان خون (Velocity) را افزایش داده و احتمال تشکیل ترومبوز سطحی را کاهش میدهد.
پروتکلهای فشار استاندارد پس از ابلیشن حرارتی (EVLA/RFA)
فشار باید فوراً پس از خروج کاتتر اعمال شود.
- فشار اولیه (Immediate Compression): پانسمان فشرده با باندهای کشی (مانند باندهای وریدی کشسان) بلافاصله پس از عمل اعمال میشود.
- فشار بلندمدت (Post-Procedural Stockings):
- فشار مورد نیاز: در درمانهای تنه اصلی، فشار توصیه شده در ناحیه مچ پا باید بین ۳۰ تا ۴۰ میلیمتر جیوه (mmHg) باشد. این سطح فشار برای تثبیت نهایی و جلوگیری از بازشدگی مجدد ورید ضروری است.
- مدت زمان: استفاده از جورابهای فشاری ۳۰-۴۰ mmHg معمولاً به مدت ۴۸ تا ۷۲ ساعت اول به صورت شبانهروزی (حتی در خواب) توصیه میشود. پس از این دوره اولیه، پوشیدن روزانه جوراب در طول روز (حداقل به مدت ۲ تا ۴ هفته) برای اطمینان از انسداد کامل و مدیریت علائم باقیمانده ضروری است.
پروتکلهای فشار درمانی پس از اسکلروتراپی
در اسکلروتراپی، به ویژه پس از UGFS برای وریدهای تنه، فشار باید کمی ملایمتر اما با مدت زمان طولانیتری اعمال شود:
- فشار اولیه: جورابهای فشاری متوسط تا قوی ((20-30 , \text{mmHg})) باید فوراً پوشیده شوند.
- مدت زمان: بیماران باید این سطح فشار را حداقل به مدت ۲ تا ۴ هفته در طول روز حفظ کنند. استفاده از جورابهای فشرده پس از اسکلروتراپی، به شدت از بازشدگی ورید و ایجاد اثرات جانبی مانند ماتینگ جلوگیری میکند.
جمعبندی و نتیجهگیری بالینی
درمان واریس های سطحی نیازمند یک رویکرد ساختار یافته است که با تشخیصی دقیق توسط اولتراسوند داپلر آغاز میشود. برای وریدهای تنه اصلی با قطر بزرگتر ((> 6 , \text{mm}))، ابلیشن حرارتی (EVLA با طول موجهای بهینه مانند (1470 , \text{nm}) یا RFA با کنترل دمایی) به دلیل نرخ انسداد بالا، به عنوان خط مقدم درمان در نظر گرفته میشود. در مقابل، اسکلروتراپی فوم هدایتشده با سونوگرافی همچنان ابزار قدرتمندی برای واریسهای شاخهای، تلانژکتزیها و درمان مکمل پس از ابلیشن است. پیروی دقیق از پروتکلهای پس از درمان، به ویژه فشار درمانی با سطوح مناسب، برای دستیابی به نتایج موفق و کاهش عود امری غیرقابل مذاکره است.